Мы рискуем каждый день, но даже не подозреваем, что некоторые напасти способны развиваться. Вирус эболы и разные штаммы гриппа могут адаптироваться – приспосабливаться все к новым и новым лекарствам, годами создаваемым целыми институтами. Эксперты предупреждают: мы вошли в постантибиотическую эру, а это означает, что ежегодно сотни тысяч людей будут заражаться и умирать от инфекций, которые раньше легко поддавались лечению антибиотиками.
Всемирная организация здравоохранения считает устойчивость бактерий к антибиотикам одной из самых серьезных угроз XXI века. На Всемирном экономическом форуме это явление назвали «вероятной катастрофой» для здоровья людей и для мировой экономики. Один лишь золотистый стафилококк, устойчивый ко многим препаратам, в 2011 году убил 11 тысяч человек только в США. А по всему миру этот стафилококк и еще один подобный микроб ежегодно убивают уже сотни тысяч людей.
Как же так получается? За счет эволюционного явления, которое Чарлз Дарвин и вообразить не мог: речь идет о комбинации естественного отбора (популяцию бактерий атакует антибиотик, выживают только сильнейшие) и парадоксального эволюционного механизма, который был открыт совсем недавно – горизонтального переноса генов. Дело в том, что гены беспрепятственно перемещаются от одного организма к другому – например, между людьми, разными видами и даже царствами природы. В 1950-х годах исследователь Нортон Зиндер назвал этот феномен «заразной наследственностью». Исследования геномов показывают, что горизонтальный перенос ДНК всегда играл важную роль, а у бактерий и вовсе является одним из основных движителей эволюции. Именно так начали распространяться гены, устойчивые к антибиотикам.
Пенициллин был открыт в 1928 году и в начале 1940-х его применяли как мощное средство против разных стафилококков. Но уже к 1955 году по всему миру, от Сиэтла до Сиднея (особенно в больницах), стали появляться штаммы бактерий, устойчивые к пенициллину.
Более полувека назад японский ученый Цутому Ватанабэ предвидел такое развитие событий: в 1963 году его группа опубликовала доклад, в котором вслед за Зиндером устойчивость к антибиотикам была названа «заразной наследственностью».
Японцы начали изучать инфекции после Второй мировой войны, когда участились случаи бактериальной дизентерии. Послевоенные лишения, переезды и сбои в работе санитарных и здравоохранительных учреждений, скорее всего, обострили проблему, но все же главной причиной болезни была бактерия рода Shigella. Лечили дизентерию в первую очередь сульфаниламидами. Когда штаммы шигеллы начали к ним приспосабливаться, врачи стали использовать новые антибиотики: стрептомицин и тетрациклин.
К 1953 году штаммы шигеллы перестали воспринимать и эти лекарства, правда, каждый штамм был устойчив только к одному из антибиотиков, другой на него действовал. Затем в 1955-м некая японка вернулась домой из Гонконга с дизентерией, и ее кишечные бактерии оказались устойчивыми к нескольким антибиотикам сразу. С того момента такие штаммы стали быстро распространяться, и в конце 1950-х Японию охватила вспышка дизентерии, вызванной суперштаммами шигеллы, устойчивыми сразу к четырем видам антибиотиков: сульфаниламидам, стрептомицину, тетрациклину и хлорамфениколу.
Тревога усилилась, когда исследователи обнаружили, что подобными свойствами обладают не только шигеллы. Некоторые штаммы кишечной палочки, взятые у пациентов, зараженных устойчивой шигеллой, оказались невосприимчивыми к тем же антибиотикам. Получается, что кишечная палочка «поделилась» своими устойчивыми генами с шигеллами. Вероятно, это произошло в кишечниках пациентов, где гены переносились от одного вида бактерии к другому. И этот обмен не ограничивался шигеллами и кишечными палочками. Дальнейшее исследование показало, что гены могут переходить от одного вида к другому, между штаммами и любой другой группой энтеробактерий – особыми микроорганизмами, которые живут в кишечнике человека.
Что же за комплекс генов так легко переходил любые границы? Ватанабэ и его коллега Тосио Фукусава предположили, что эти гены – эписома, автономный генетический элемент, который существует внутри бактериальной клетки и не присоединяется к ее хромосомам. Эписома – это фрагмент ДНК кольцевой формы. Она может находиться и воспроизводиться в клетке вне зависимости от клеточных хромосом. Эписома наделена свойствами, которые в обычной жизни не нужны, но в экстренном случае пригодятся: например, устойчивость к засухе или к яду.
В 1963 году в своем докладе Ватанабэ сообщил всемирному научному сообществу то, что они с Фукусавой уже рассказали в Японии: устойчивость сразу и к стрептомицину, и к трем другим антибиотикам закодирована в эписоме. Именно эписома позволяет относительно безобидной кишечной палочке передавать гены с новыми свойствами другим видам, включая опасные Shigella dysenteriae. Слово «эписома» позже заменят термином «плазмида». Ученые признают плазмиды мощным механизмом передачи генов и даже целых генных комплексов, устойчивых к антибиотикам, между видами бактерий.
Ванкомицин получен в 1972 году и назван по латинскому корню vincere, «побеждать», потому что ванкомицин мог убивать штаммы бактерий, устойчивые к другим антибиотикам. Но уже к концу 1980-х у энтерококков появился ген, невосприимчивый к ванкомицину – vanA, и всего через десять лет этот ген путем горизонтального переноса распространился среди других бактерий: от энтерококка к стафилококку, включая золотистый.
К 1996 году в Японии были установлены случаи стафилококковых инфекций, устойчивых к ванкомицину. В начале 2000-х то же случилось в США. И это было только начало.
Еще одно пугающее эволюционное изменение в мире бактерий открыла группа китайских ученых два года назад. Исследователи обнаружили ген, невосприимчивый к колистину – препарату последнего поколения, который уже объявили «критически важным для медицины», – в кишечной палочке, взятой у свиньи. Гену присвоили название mcr-1. И самое страшное свойство mcr-1 – сродство к плазмиде, благодаря чему он может легко и быстро переходить от одного вида бактерий к другому при горизонтальном переносе.
Вскоре после этого открытия прошла волна публикаций других ученых, которые заявляли, что тоже нашли mcr-1 на бактериальных плазмидах: в моче 83-летнего швейцарца, в датской курице, во фламандских поросятах, в кале госпитализированного ребенка из Камбоджи и много где еще. А это означает только одно: очень скоро колистин перестанет убивать целый ряд бактерий.
Метициллин появился в 1959 году и был особенно эффективен при лечении неубиваемого пенициллином золотистого стафилококка. Но к 1972-му в Англии, США, Польше, Эфиопии, Индии и Вьетнаме появился штамм, невосприимчивый и к митициллину.
В середине прошлого века слава о Цутому Ватанабэ прокатилась по всему миру. Юный американский студент Стюарт Б. Леви услышал о нем, когда искал подработку во время учебы в медуниверситете.
В 1962 году Леви смог на несколько месяцев попасть в лабораторию Ватанабэ в Университете Кэйо в Токио. Работа с Ватанабэ определила дальнейшую карьеру Стюарта. Сегодня доктор Леви – профессор в Медицинской школе Университета Тафтса и всемирно признанный специалист в области резистентности к антибиотикам, применения и передозировки препаратов данной группы. Я приехал в его офис, находящийся на восьмом этаже унылого здания неподалеку от бостонского Чайна-тауна, и доктор Леви поделился со мной воспоминаниями о Ватанабэ.
«Мы работали в лаборатории без кондиционера, – рассказал Леви, – было очень жарко и влажно». Лабораторный стол Леви находился на верхнем этаже, с которого он мог видеть, как профессор Ватанабэ в рубашке с коротким рукавом, «потому что слишком уж жарко», проводит эксперименты. Время от времени кто-нибудь приносил шланг и обливал профессора водой, чтобы ему стало попрохладнее. Низенький, сантиметров на пять ниже невысокого Леви, профессор Ватанабэ безупречно владел английским и славился своей прямолинейностью среди студентов и молодых ученых. Он ездил по университетскому городку на велосипеде вместе с младшими коллегами и иногда водил их в бар на караоке. Когда Ватанабэ приехал в Филадельфию на научную конференцию, он остановился в доме родителей Леви (те жили неподалеку от места проведения мероприятия).
«Я был очень рад, потому что в определенном смысле поклонялся профессору», – вспоминает Леви. Ватанабэ был опытным наставником, квалифицированным и достойным японским ученым. Но что же с ним стало?
«Он умер от рака желудка, – сказал Леви. – Ему было что-то около пятидесяти».
Закончив учебу, доктор Леви посвятил себя защите мира от супербактерий. В 1992 году он опубликовал книгу «Парадокс антибиотиков». Парадоксом Леви назвал тот факт, что лекарства, которые значительно облегчили и продлили жизнь людей в XX веке, сделали бактерии намного опаснее, вынудив приспособиться к новым для них вызовам среды обитания – человеческого тела. Леви писал, что распространение устойчивых генов с помощью плазмид еще во времена Ватанабэ «открыло глаза микробиологам и ученым-медикам на невиданный дотоле масштаб распространения генов». Тогда не все представляли последствия, но сегодня гены, невосприимчивые к антибиотикам, стремительно и неумолимо распространяются по всей планете.
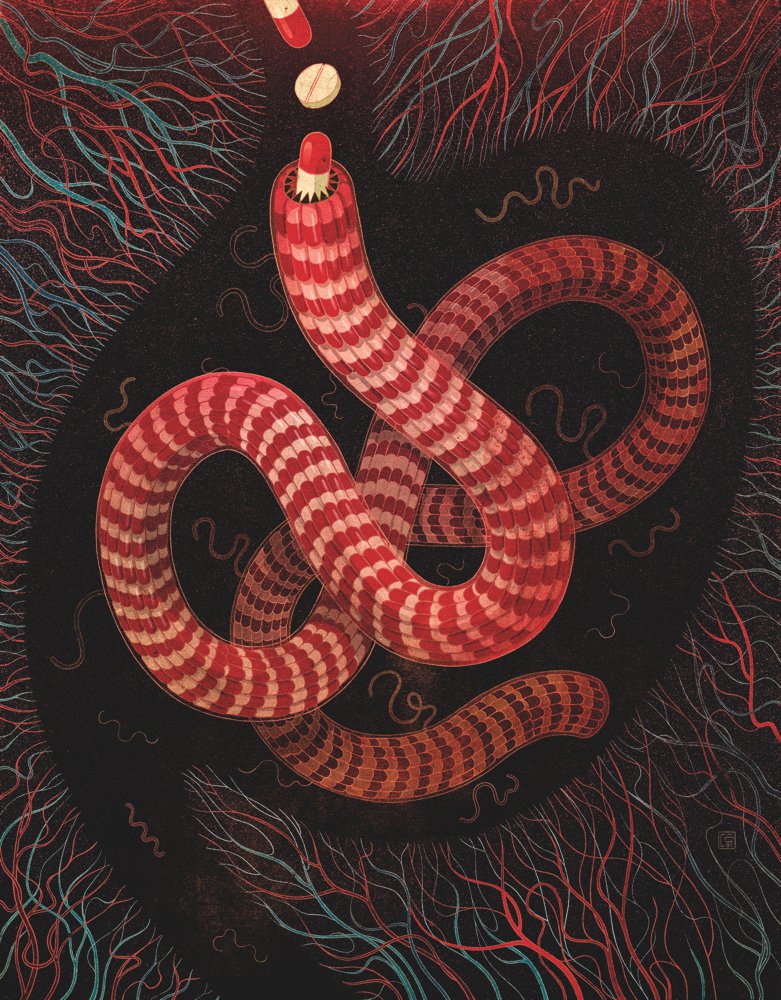
На рисунке выше художница Викто Нгай изобразила, как антибиотики, попадающие в кишечник, «помогают суперспирохете превзойти обычных спирохет», – объясняет Викто. «Новая бактерия, – рассказывает она, – состоит из десятков таблеток, показывая, что чрезмерное потребление антибиотиков лишь делает бактерию сильнее».
Введите слово или фразу для поиска: (например, «профендер»)
22.12.2021
Пьяные попугаи затерроризировали жителей города Подробнее »
21.12.2021
Школьник пошел в туалет и пережил нападение медведя-губача Подробнее »
20.12.2021
Огромный крокодил целиком проглотил акулу на глазах у рыбаков Подробнее »